 |
 |
- Search
| J Electrodiagn Neuromuscul Dis > Volume 22(1); 2020 > Article |
|
Abstract
Hemifacial spasm (HFS) is due to the vascular compression of the facial nerve at its root exit zone (REZ). Microvascular decompression (MVD) of the facial nerve near the REZ is an effective and curative treatment for HFS. In MVD for HFS, intraoperative neurophysiological monitoring (IONM) has two purposes. The first purpose is to prevent injury to neural structures such as the vestibulocochlear nerve and facial nerve during MVD surgery, which is possible through IONM of brainstem auditory evoked potentials and facial nerve electromyography (EMG). The second purpose is the unique feature of MVD for HFS, which is to assess and optimize the effectiveness of the vascular decompression. The purpose is achieved mainly through monitoring of abnormal facial nerve EMG that is called as lateral spread response (LSR) and is also partially possible through Z-L response, facial F-wave, and facial motor evoked potentials. Through IONM mentioned above, MVD can be developed as a more safe and effective treatment for HFS.
ļ░śņ¬Įņ¢╝ĻĄ┤ņŚ░ņČĢ (Hemifacial spasm, HFS)ņØĆ ļ░śņ¬Įņ¢╝ĻĄ┤ĻĘ╝ņ£ĪņØ┤ ļČłņłśņØśņĀü, Ļ░äĒŚÉņĀü ĻĘĖļ”¼Ļ│Ā ļČłĻĘ£ņ╣ÖņĀüņ£╝ļĪ£ ņłśņČĢĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£ņä£, ļ│┤ĒåĄ ļłłļæśļĀłĻĘ╝ņ£Ī (orbicularis oculi muscle)ņŚÉņä£ ņŗ£ņ×æļÉśņ¢┤ ņĀÉņ░© ļ░śņ¬Įņ¢╝ĻĄ┤ņØś ļ¬©ļōĀ ĻĘ╝ņ£ĪņØ┤ ļČłņłśņØśņĀüņ£╝ļĪ£ ņłśņČĢĒĢśļŖö ņ¦łĒÖśņØ┤ļŗż.1-4 ļ│æļ”¼ņĀüņ£╝ļĪ£, ņØ┤ ņ¦łĒÖśņØĆ ļćīņżäĻĖ░ļĪ£ļČĆĒä░ ņ¢╝ĻĄ┤ņŗĀĻ▓Į (facial nerve)ņØ┤ ļéśņśżļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓Į ĻĖ░ņŗ£ļČĆ (Root exit zone, REZ)ļź╝ ņŻ╝ļ│ĆņØś ļćīĒśłĻ┤ĆņØ┤ ņĢĢļ░ĢĒĢśņŚ¼, ņ¢╝ĻĄ┤ņŗĀĻ▓Į Ēś╣ņØĆ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄ (facial nucleus)ņØś ĻĖ░ļŖźņĀü ļ│Ćņä▒ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņāØĻĖ░ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.1,4,5 HFSņØś ņ╣śļŻīļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĻ│╝ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØä ņĢĢļ░ĢĒĢśļŖö ĒśłĻ┤ĆņØä ļČäļ”¼ņŗ£ĒéżļŖö ļ»ĖņäĖĒśłĻ┤ĆĻ░ÉņĢĢņłĀ (microvascular decompression, MVD)ņØ┤ ĻĘ╝ļ│ĖņĀüņØĖ ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, ņØ┤ļŖö ļīĆļץ 80 %ņŚÉņä£ 100 % ņé¼ņØ┤ņØś ļåÆņØĆ ņÖäņ╣śņ£©ņØä ļ│┤ņØĖļŗż.6,7
HFSņŚÉ ļīĆĒĢ£ MVD ņżæ ņŗ£Ē¢ēļÉśļŖö ņłśņłĀ ņżæ ņŗĀĻ▓ĮĻ│äĻ░Éņŗ£ (intraoperative Neurophysiological Monitoring, IONM) Ļ▓Ćņé¼ļŖö Ēü¼Ļ▓ī 2Ļ░Ćņ¦ĆņØś ņ£ĀņÜ®ņä▒ņØ┤ ņ׳ļŗż. ņ▓½ņ¦ĖļŖö IONM Ļ▓Ćņé¼ ĒåĄĒĢ┤ MVD ņŗ£Ē¢ē ņżæ ļ░£ņāØĒĢĀ ņłś ņ׳ļŖö ņŗĀĻ▓ĮĻ│ä ņåÉņāüņØä ļ¦ēņØä ņłś ņ׳ļŗż. ņĀäņĀĢņÖĆņÜ░ņŗĀĻ▓Į (vestibulocochlear nerve, CN VIII)ņØ┤ ņ¢╝ĻĄ┤ņŗĀĻ▓Į REZņŚÉņä£ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĻ│╝ ņØĖņĀæĒĢ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ, HFSņŚÉ ļīĆĒĢ£ MVD ņżæņŚÉ CN VIIIņØ┤ ņåÉņāüļÉĀ ņ£äĒŚśņØ┤ ļåÆļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£, ļćīņżäĻĖ░ņ▓ŁĻ░üņ£Āļ░£ņĀäņ£ä (brainstem auditory evoked potentials, BAEPs) Ļ▓Ćņé¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņłśņłĀ ņżæ ņ▓ŁĻ░üņŗĀĻ▓ĮĻ▓ĮļĪ£ļź╝ Ļ░Éņŗ£ĒĢĀ ļĢī, CN VIII ņåÉņāüņ£╝ļĪ£ ņØĖĒĢ£ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗż (postoperative hearing loss)ļź╝ ļ¦ēņØä ņłś ņ׳ļŗż. ļśÉĒĢ£, ņłśņłĀ ņżæ ņ¢╝ĻĄ┤ĻĘ╝ņ£ĪņØś ĻĘ╝ņĀäļÅä (electromyography, EMG) Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ņä£ļÅä, ņłśņłĀ ņżæ ļ░£ņāØĒĢśļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ņåÉņāüņØä Ļ░Éņŗ£ĒĢĀ ņłś ņ׳ļŗż. ļæÉļ▓łņ¦ĖļŖö IONM Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ HFSņŚÉ ļīĆĒĢ£ MVDņØś ņä▒Ļ│ĄļźĀņØä ļåÆņØ╝ ņłś ņ׳ļŗż. HFSņŚÉņä£ļŖö ņĖĪļ®┤ņĀäĒīīļ░śņØæ (lateral spread response, LSR)ņØ┤ļØ╝ļŖö ĒŖ╣ņ¦ĢņĀüņØĖ ņĀäĻĖ░ņāØļ”¼ĒĢÖņĀü ņØ┤ņāüņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż. ņØ┤ļŖö ĒĢśļéśņØś ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦Ćļź╝ ņ×ÉĻĘ╣ĒĢśņśĆņØä ļĢī ĻĘĖ ņŗĀĻ▓ĮņŚÉņä£ ņ¦Ćļ░░ļ░øļŖö ĻĘ╝ņ£Īļ┐É ņĢäļŗłļØ╝, Ļ░ÖņØĆ ņ¬Į ņ¢╝ĻĄ┤ņØś ļŗżļźĖ ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦ĆļĪ£ļČĆĒä░ ņ¦Ćļ░░ļ░øļŖö ĻĘ╝ņ£ĪņŚÉņä£ļÅä ņĀäĻĖ░ņĀü ļ░śņØæņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓āņØ┤ļŗż. HFSņŚÉ ļīĆĒĢ£ MVD ņżæ, LSRņØ┤ ņåīņŗżļÉśĻ▒░ļéś, Ēś╣ņØĆ LSRņØś ņ¦äĒÅŁņØ┤ Ļ░ÉņåīļÉĀ Ļ▓ĮņÜ░, ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØä ņĢĢļ░ĢĒĢśļŹś ļ¼ĖņĀ£ņØś ĒśłĻ┤Ć(offending vessel)ņŚÉ ļīĆĒĢ£ Ļ░ÉņĢĢņØ┤ ņĀüņĀłĒĢśĻ▓ī ņØ┤ļŻ©ņ¢┤ņ¦ä Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£, ņØ┤ LSRņØä ņØ┤ņÜ®ĒĢśņŚ¼ HFSņØä ņ£Āļ░£ņŗ£Ēé© ļ¼ĖņĀ£ņØś ĒśłĻ┤ĆņØä ĒÖĢņØĖĒĢśņŚ¼ MVDņØś ņĀĢĒÖĢļÅäļź╝ ļåÆņØ┤Ļ│Ā, ņä▒Ļ│ĄļźĀņØä Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ļŗż. ĻĘĖ ņÖĖņŚÉļÅä Z-L ļ░śņØæ (Z-L response), ņ¢╝ĻĄ┤ņŗĀĻ▓Į F Ēīī (facial F-waves) ļ░Å ņ¢╝ĻĄ┤ ņŗĀĻ▓Į ņÜ┤ļÅÖ ņ£Āļ░£ ņĀäņ£ä (facial motor evoked potentials) Ļ▓Ćņé¼ ļō▒ņØ┤ HFSņŚÉ ļīĆĒĢ£ MVDņØś ņĀĢĒÖĢļÅä ļ░Å ņĢłņĀĢņä▒ņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.
ļ│Ėļ¼ĖņŚÉņä£ļŖö HFSņŚÉņä£ ņé¼ņÜ®ļÉśļŖö ļīĆĒæ£ņĀüņØĖ IONM ļ░®ļ▓ĢņØĖ BAEPs, LSRņØä ņżæņŗ¼ņ£╝ļĪ£ ĻĖ░ņłĀĒĢśĻ│Ā, ĻĘĖ ņÖĖ Z-L ļ░śņØæ, ņ¢╝ĻĄ┤ņŗĀĻ▓Į F Ēīī ļ░Å ņ¢╝ĻĄ┤ ņŗĀĻ▓Į ņÜ┤ļÅÖ ņ£Āļ░£ ņĀäņ£ä Ļ▓Ćņé¼ņŚÉ ļīĆĒĢ┤ņä£ļÅä ņåīĻ░£ĒĢśĻ▓Āļŗż.
HFSņŚÉ ļīĆĒĢ┤ MVDļź╝ ņŗ£Ē¢ēĒĢĀ ļĢī, Ļ░Ćņן ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”ØņØĆ CN VIIIņØś ņåÉņāüņ£╝ļĪ£ ņØĖĒĢ£ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØ┤ļŗż. CN VIII ņåÉņāüņØĆ MVD ņżæ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņØ┤ņ£ĀļĪ£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż: ņåīļćī ļÆżļŗ╣Ļ╣Ć (cerebellar retraction) ņżæ CN VIIIņØś ļŗ╣Ļ╣ĆņŚÉ ņØśĒĢ£ ņåÉņāü, ņŗĀĻ▓Į-ĒśłĻ┤Ć Ļ░ÉņĢĢ ņżæ ĒśłĻ┤Ć ņŚ░ņČĢ (vasospasm)ņ£╝ļĪ£ ņØĖĒĢ£ ĒŚłĒśłņä▒ ņåÉņāü, ņłśņłĀ ņżæ ĻĖ░Ļ│äņĀü Ēś╣ņØĆ ņŚ┤ ņåÉņāü, ņéĮņ×ģļÉ£ ĒģīĒöīļĪĀ Ēī©ļō£(Teflon pad)ņØś ņĢĢļ░Ģ ļō▒ļō▒.8 MVD ņżæ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗż ļ░£ņāØļźĀņØĆ Ļ│╝Ļ▒░ ņŚ░ĻĄ¼ņŚÉņä£ BAEPs ņØ┤ņÜ®ĒĢ£ IONM Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņØä Ļ▓ĮņÜ░, 7.7%ņŚÉņä£ 20%Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉśņŚłļŗż.3 ĒĢśņ¦Ćļ¦ī, BAEPsļź╝ ņØ┤ņÜ®ĒĢ£ IONM Ļ▓Ćņé¼Ļ░Ć ļÅäņ×ģļÉ£ ņØ┤Ēøä, ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØĆ 2% ņØ┤ĒĢśļĪ£ Ēü¼Ļ▓ī Ļ░ÉņåīĒĢśņśĆĻ│Ā, Ēśäņ×¼ļŖö BAEPsļź╝ ņØ┤ņÜ®ĒĢ£ IONMļŖö HFSņŚÉ ļīĆĒĢ£ MVD ņŗ£Ē¢ēņŗ£ ĒĢäņłśņĀüņØĖ Ļ▓Ćņé¼ļĪ£ ņŚ¼Ļ▓©ņ¦ĆĻ│Ā ņ׳ļŗż.6,9
BAEPsļŖö ņØīĒ¢ź ņŗĀĒśĖļź╝ ņāØņä▒ĒĢśļŖö ĒŖĖļ×£ņŖżļōĆņä£ņŚÉ 100 msecņØś ņĀäĻĖ░ ĒÄäņŖżļź╝ ņĀäļŗ¼ĒĢśņŚ¼ ļ░£ņāØĒĢśļŖö Ēü┤ļ”Ł ņ×ÉĻĘ╣ņŚÉ ņØśĒĢ┤ ņ£Āļ░£ļÉ£ļŗż. ņ×ÉĻĘ╣ņäĖĻĖ░ļŖö ļ¬ģĒÖĢĒĢ£ BAEPsļź╝ ņāØņä▒ĒĢśĻĖ░ņŚÉ ņČ®ļČäĒ׳ ļåÆĻ▓ī ņäżņĀĢĒĢ┤ņĢ╝ ĒĢśņ¦Ćļ¦ī, ņ▓ŁĻ░ü ņåÉņāüņØä ņØ╝ņ£╝Ēé¼ ņĀĢļÅäļĪ£ ļåÆĻ▓ī ņäżņĀĢĒĢĀ ņłś ņŚåļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ 100 dB sound pressure level (SPL) ļśÉļŖö 60-70 dB hearing level (HL)ņØś ņ×ÉĻĘ╣ņäĖĻĖ░Ļ░Ć ņØ┤ņÜ®ļÉśĻ│Ā, ĻĄÉņ░©ļ░śņØæ(crossover responses)ļź╝ ļ¦ēĻĖ░ ņ£äĒĢ┤ Ļ▓Ćņé¼ļź╝ Ē¢ēĒĢĀ ļĢī ļ░śļīĆņĖĪ ĻĘĆņŚÉļŖö Ļ▓Ćņé¼ņĖĪ ĻĘĆļ│┤ļŗż 30-40 dB ņĀĢļÅä ļé«ņØĆ 60 dB SPL ļśÉļŖö 30-35 dB HLņØś ļ░▒ņāēņåīņØī(white noise)ņØä ņĀüņÜ®ĒĢ£ļŗż.10 ņ×ÉĻĘ╣ ļ░®ņŗØņØĆ ĒŖĖļ×£ņŖżļōĆņä£ ļŗżņØ┤ņ¢┤ĒöäļשņØś ņ┤łĻĖ░ ņøĆņ¦üņ×äņŚÉ ļö░ļØ╝ ņØæņČĢ(condensation)Ļ│╝ ĒؼņäØ(rarefaction)ņØ┤ļØ╝ļŖö 2Ļ░Ćņ¦Ć ļ░®ņŗØņØ┤ Ļ░ĆļŖźĒĢ£ļŹ░, IONM ņŚÉņä£ļŖö ņ×ÉĻĘ╣ ņ×ĪĒīīļź╝ ņĄ£ņåīĒÖöĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļ»ĆļĪ£ ņØæņČĢĻ│╝ ĒؼņäØņØä ļ▓łĻ░łņĢä ņé¼ņÜ®ĒĢśļŖö ĻĄÉļīĆĻĘ╣ņä▒ (alternating polarity) ņ×ÉĻĘ╣ ļ░®ņŗØņØ┤ ņäĀĒśĖļÉ£ļŗż.
ņÜ░ļ”¼Ļ░Ć ņØ╝ļ░śņĀüņ£╝ļĪ£ ņŗĀĻ▓ĮņāØļ”¼Ļ▓Ćņé¼ņŚÉņä£ ņé¼ņÜ®ļÉśļŖö BAEPsļŖö ĒĢ£ļ▓łņØś ņ×ÉĻĘ╣ņ£╝ļĪ£ ņ¢╗ņ¢┤ņ¦ä ĒĢśļéśņØś BAEP ĒīīĒśĢņØ┤ ņĢäļŗłļØ╝, ņŚ¼ļ¤¼ ļ▓łņØś ņ×ÉĻĘ╣ņ£╝ļĪ£ ņ¢╗ņ¢┤ņ¦ä ļ│ĄņłśņØś BAEP ĒīīĒśĢņØä ĒĢ®ņ│Éņä£ ņ¢╗ņ¢┤ņ¦ĆļŖö Ļ▓āņØ┤ļŗż. ĻĘĖļĀćĻĖ░ņŚÉ, ĒÖ£ņÜ® Ļ░ĆļŖźĒĢ£ BAEPsļź╝ ņ¢╗ņØä ļĢī, Ļ▓Ćņé¼ņ×ÉĻ░Ć ņĪ░ņ×æĒĢĀ ņłś ņ׳ļŖö ņŻ╝ņÜöĒĢ£ ļ│Ćņłś 2 Ļ░Ćņ¦ĆĻ░Ć ņ׳ļŖöļŹ░, ņØ┤ļŖö ņ×ÉĻĘ╣ļ╣łļÅä(stimulus rate)ņÖĆ ĒÅēĻĘĀĒÖöĒܤņłś (averaging trials)ņØ┤ļŗż. 2006ļģä ļ»ĖĻĄŁņ×äņāüņŗĀĻ▓ĮņāØļ”¼ĒĢÖĒÜī (American Clinical Neurophysiology Society, ACNS)ļŖö BAEPs Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ļĢī,10 Hz ņØ┤ņāüņØś ņ×ÉĻĘ╣ņØĆ BAEPs ĒīīĒśĢņØś ņ¦äĒÅŁņØä Ļ░Éņåīņŗ£Ēé¼ ņÜ░ļĀżĻ░Ć ņ׳ņ¢┤ņä£ 8-10 HzņØś ļé«ņØĆ ņ×ÉĻĘ╣ļ╣łļÅäļź╝ ĻČīņןĒ¢łļŗż.11,12 ļśÉĒĢ£ ACNSņŚÉņä£ļŖö ĒĢ┤ņäØ Ļ░ĆļŖźĒĢśĻ│Ā ņ×¼Ēśäņä▒ ņ׳ļŖö BAEPsļź╝ ņ¢╗ĻĖ░ ņ£äĒĢ┤, 1000-4000ĒÜīņØś ļåÆņØĆ ĒÅēĻĘĀĒÖö ĒܤņłśĻ░Ć ĒĢäņÜöĒĢśļŗżĻ│Ā ņĀ£ņŗ£Ē¢łļŗż. ļ¦īņØ╝ ĒĢśļéśņØś ĒĢ┤ņäØĻ░ĆļŖźĒĢ£ BAEPsļź╝ ņ¢╗ļŖöļŹ░, 10 HzņØś ņ×ÉĻĘ╣ļ╣łļÅäņÖĆ 1000ĒÜīņØś ĒÅēĻĘĀĒÖöĒܤņłśļź╝ ņĀüņÜ®ĒĢ£ļŗżļ®┤, ĒĢ£ļ▓łņØś BAEPsņØś ĒīīĒśĢņØä ņ¢╗ļŖöļŹ░ 100ņ┤łņØś ņŗ£Ļ░äņØ┤ ņåīņÜöļÉ£ļŗż. ņÖĖļלĻ▓Ćņé¼ņÖĆ Ļ░ÖņØ┤ ņ¦łĒÖśņØś ņ£Āļ¼┤ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢśļŖö Ļ▓Ćņé¼ļØ╝ļ®┤, ņśżļ×£ ņŗ£Ļ░äņØ┤ Ļ▒ĖļĀżļÅä ņĀĢĒÖĢĒĢ£ ĒīīĒśĢņØä ņ¢╗ļŖö Ļ▓āņØ┤ ļ│┤ļŗż ņóŗņØĆ Ļ▓Ćņé¼ļ░®ļ▓ĢņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī, IONMņŚÉņä£ļŖö ņłśņłĀ ņżæ ļ░£ņāØĒĢĀ ņłś ņ׳ļŖö ņŗĀĻ▓ĮņåÉņāü ņ£Āļ¼┤ļź╝ ļ╣©ļ”¼ ĒÖĢņØĖĒĢśĻ│Ā ņØ┤ļź╝ ļ¦ēņĢäņĢ╝ ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ņāüļīĆņĀüņ£╝ļĪ£ ņśżļ×£ ņŗ£Ļ░äņØ┤ Ļ▒Ėļ”░ļŗżļ®┤ ņØ┤ļŖö ņ£ĀņÜ®ĒĢ£ Ļ▓Ćņé¼ļ░®ļ▓ĢņØ┤ļØ╝Ļ│Ā ļ¦ÉĒĢśĻĖ░ ņ¢┤ļĀĄļŗż. ĒĢ┤ņäØĻ░ĆļŖźĒĢ£ BAEPsļź╝ ņ¢╗ļŖöļŹ░ ņāüļīĆņĀüņ£╝ļĪ£ ņśżļ×£ ņŗ£Ļ░äņØ┤ Ļ▒Ėļ”┤ Ļ▓ĮņÜ░, ņØ┤ļŖö ņŗĀĻ▓ĮņåÉņāü ņŚ¼ļČĆļź╝ ļŖ”Ļ▓ī ļ░£Ļ▓¼ĒĢśņŚ¼ ņ▓ŁļĀź ņåīņŗżņØä ļ¦ēņØä ņłś ņ׳ļŖö ņĀüņĀĢņŗ£ĻĖ░ļź╝ ļåōņ╣Ā Ļ░ĆļŖźņä▒ņØ┤ ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż (Fig. 1). ĒĢśņ¦Ćļ¦ī, Ļ│╝Ļ▒░ņÖĆ ļŗ¼ļ”¼ IONM ņןļ╣äņØś ļ░£ņĀäņ£╝ļĪ£ ņŗĀĒśĖ-ņ×ĪņØī ļ╣ä (signal to noise ratio)Ļ░Ć Ļ░£ņäĀļÉśņŚłĻ│Ā, Ļ│Āļ╣łļÅä (high frequency) ņ×ÉĻĘ╣ņØ┤ Ļ░ĆļŖźĒĢĀ ļ┐É ņĢäļŗłļØ╝, Ļ│Āļ╣łļÅä ņ×ÉĻĘ╣ņŗ£ ļ░£ņāØĒĢśļŹś ņŗĀĒśĖ ņÖ£Ļ│Ī ļ¼ĖņĀ£Ļ░Ć Ēü¼Ļ▓ī Ļ░£ņäĀļÉśņŚłļŗż. ņŗżņĀ£ļĪ£, 2016ļģä ņĀĆņ×Éļź╝ ĒżĒĢ©ĒĢ£ ĻĄŁļé┤ ņŚ░ĻĄ¼ņ¦äņØĆ 43.9 HzņØś ņ×ÉĻĘ╣ļ╣łļÅäņÖĆ 400ĒÜīņØś ĒÅēĻĘĀĒܤņłśļź╝ ņĀüņÜ®ĒĢśņśĆņØä ļĢī, ņŗĀļó░ĒĢĀ ņłś ņ׳ļŖö BAEPsļź╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ¢╗ļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ņĀ£ņŗ£ĒĢśņśĆĻ│Ā, ĒĢśļéśņØś ĒĢ┤ņäØ Ļ░ĆļŖźĒĢ£ BAEPs ņ¢╗ļŖöļŹ░ Ļ▒Ėļ”¼ļŖö ņŗ£Ļ░äņØä 10ņ┤ł ļ»Ėļ¦īņ£╝ļĪ£ ļŗ©ņČĢņŗ£ņ╝░ļŗż.13 ļŹö ļéśņĢäĻ░Ć, BAEPs ņĖĪņĀĢņØś ņāłļĪ£ņÜ┤ ļ░®ņŗØņØä ņĀüņÜ®ĒĢśņśĆņØä ļĢī, ņØ┤ņĀä ļ░®ņŗØĻ│╝ ļ╣äĻĄÉņŗ£ņŚÉ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä Ēü¼Ļ▓ī Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ņØīņØä ņ”Øļ¬ģĒĢśņśĆļŗż. (4.02% vs 0.39%, p=0.002) (Table 1)
BAEPsņØś IONMņØä ņé¼ņÜ®ĒĢĀ ļĢī, BAEPsņØś ņŚ¼ļ¤¼ ĒīīĒśĢ ņżæ ņŻ╝ļĪ£ ĒīīĒśĢ VņØ┤ ņØ┤ņÜ®ļÉ£ļŗż. ņØ┤ļŖö ĒīīĒśĢ VņØ┤ ņżæĻ░äļćī (midbrain)ņŚÉņä£ ņ¢╗ņ¢┤ņ¦ä ĒīīĒśĢ ņ×äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ļŗżļźĖ ĒīīĒśĢņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņ¦äĒÅŁņØ┤ Ēü¼Ļ│Ā ļČäļ¬ģĒĢśļ®░, ļśÉĒĢ£ ņłśņłĀ ņżæ ņĀüņÜ®ļÉśļŖö ļ¦łņĘ©ņŚÉ ļīĆĒĢ┤ņä£ļÅä ņāüļīĆņĀüņ£╝ļĪ£ ņśüĒ¢źņØä ļŹ£ ļ░øĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņ¦Ćļé£ 40ļģäĻ░ä BAEPsļź╝ ņØ┤ņÜ®ĒĢ£ IONM ņĀüņÜ®ĒĢĀ Ļ▓ĮņÜ░, MVD ņżæ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ņśłļ░®ĒĢĀ ņłś ņ׳ļŗżļŖö ļČäļ¬ģĒĢ£ ņ”ØĻ▒░ļōżņØ┤ ļ¦ÄņØ┤ ņ׳ņŚłļŗż. ĒĢśņ¦Ćļ¦ī, ņŚ¼ņĀäĒ׳ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ņśłņĖĪĒĢśļŖö BAEPsņØś Ļ▓ĮĻ│ä ĻĖ░ņżĆ (Warning criteria)ņŚÉ ļīĆĒĢ£ ĒĢ®ņØśĻ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗż.14 Ļ│╝Ļ▒░, Polo ļō▒ņØĆ ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░Ļ░Ć 0.6 msec ņŚ░ņןļÉśļŖö Ļ▓āņØ┤ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżĻ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ļåÆļŗżĻ│Ā ņĀ£ņŗ£ĒĢśņśĆļŗż.15 Grundy ļæźņØĆ wave VņØś ņ×Āļ│ĄĻĖ░Ļ░Ć 1.5 msec ņŚ░ņןļÉĀ Ļ▓ĮņÜ░ļź╝ Ļ▓ĮĻ│ä ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ĒĢ┤ņĢ╝ĒĢ£ļŗżĻ│Ā ņĀ£ņŗ£Ē¢łļŗż.16 ļ░śļīĆļĪ£, HatayamaņÖĆ M├Ėller ļō▒ņØĆ ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ ņŚ░ņןņØĆ ĒĢŁņāü ĒīīĒśĢ VņØś ņ¦äĒÅŁ Ļ░ÉņåīņÖĆ ļÅÖļ░śļÉśĻ│Ā, ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ļ│┤ņśĆļŹś ĒÖśņ×ÉņŚÉņä£ ĒīīĒśĢ V ņ¦äĒÅŁ Ļ░ÉņåīĻ░Ć ņ×Āļ│ĄĻĖ░ ņŚ░ņןļ│┤ļŗż ļ│┤ļŗż ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆĻĖ░ņŚÉ, ĒīīĒśĢ VņØś ņ¦äĒÅŁ Ļ░ÉņåīĻ░Ć ļ│┤ļŗż ņ£ĀņÜ®ĒĢ£ Ļ▓ĮĻ│ä ĻĖ░ņżĆņØ┤ļØ╝Ļ│Ā ņŻ╝ņןĒĢśņśĆļŗż.17 ņĄ£ĻĘ╝, Thirumala ļō▒ņØĆ ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ ņŚ░ņן Ēś╣ņØĆ ņ¦äĒÅŁņØś Ļ░Éņåīļ│┤ļŗżļŖö ĒīīĒśĢ VĻ░Ć ņØ╝ņŗ£ņĀü Ēś╣ņØĆ ņśüĻĄ¼ņĀüņ£╝ļĪ£ ņåīņŗżļÉ£ Ļ▓ĮņÜ░Ļ░Ć ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżĻ│╝ ņ¦üņĀæņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.18 ĻĘĖļōżņØĆ ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ 5 msec ņŚ░ņן Ēś╣ņØĆ ņ¦äĒÅŁņØś 50% Ļ░Éņåīļź╝ ļ│┤ņØĖ ĒÖśņ×É ņżæ 10.2%, ņØ╝ņŗ£ņĀüņØĖ ĒīīĒśĢ ņåīņŗżņØä ļ│┤ņØĖ ĒÖśņ×ÉļŖö 25%, ĻĘĖļ”¼Ļ│Ā ņśüĻĄ¼ņĀüņØĖ ņåīņŗżņØä ļ│┤ņØĖ ĒÖśņ×Éļōż ņżæ 60%Ļ░Ć ņ▓ŁļĀź ņåīņŗżļĪ£ ņØ┤ņ¢┤ņĪīļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņ£äņÖĆ Ļ░ÖņØ┤ Ļ│╝Ļ▒░ ņ£ĀņÜ®ĒĢ£ Ļ▓ĮĻ│ä ĻĖ░ņżĆņŚÉ ļīĆĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ņØ┤ņŚÉ ļīĆĒĢ£ Ļ│ĄĒåĄļÉ£ ĻĖ░ņżĆņØ┤ ļČĆņ×¼Ē¢łņŚłļŗż. ņŚ¼ņĀäĒ׳ ļ¦ÄņØĆ ņŚ░ĻĄ¼ņ×ÉļōżņØĆ Ļ▓ĮĒŚśņĀüņ£╝ļĪ£ 2ĒÜī ņŚ░ņåŹ BAEPs ņāü ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ 1mec ņŚ░ņן Ēś╣ņØĆ ņ¦äĒÅŁ 50% Ļ░Éņåīļź╝ ņĢīļ×ī ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆļŗż.11,12
ĒĢśņ¦Ćļ¦ī, ļČĆņĀĢĒÖĢĒĢ£ Ļ▓ĮĻ│ä ĻĖ░ņżĆņØĆ ļ¦żņÜ░ ņŗ¼Ļ░üĒĢ£ ļ¼ĖņĀ£ņØ┤ļŗż. Ļ▓ĮĻ│ä ĻĖ░ņżĆņØ┤ ļČĆņĀĢĒÖĢĒĢĀ Ļ▓ĮņÜ░, ņØ┤ļź╝ ĒÖĢņØĖĒĢśĻ│Ā ĻĄÉņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ļČłĒĢäņÜöĒĢśĻ▓ī ņłśņłĀņŗ£Ļ░äņØ┤ ņ¦ĆņŚ░ļÉśĻ│Ā, ļŹö ļéśņĢäĻ░Ć ļČłĒĢäņÜöĒĢ£ ņĪ░ņ×æņ£╝ļĪ£ ņłśņłĀ ņżæ ĒĢ®ļ│æņ”ØņØä ņ£ĀļÅäĒĢĀ ņÜ░ļĀżĻ░Ć ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņØ┤ņŚÉ ļīĆĒĢ┤ ĻĄŁļé┤ņŚÉņä£ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżĻ│╝ ņŚ░Ļ┤ĆļÉ£ Ļ▓ĮĻ│ä ĻĖ░ņżĆņØä ĒÖĢļ”ĮĒĢśĻĖ░ ņ£äĒĢ┤, 932ļ¬ģņØś HFS ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēļÉ£ MVD ņżæ ĻĖ░ļĪØļÉ£ BAEPsņÖĆ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒĢśņśĆļŗż. ĻĘĖļōżņØĆ ĒĢ┤ņäØĻ░ĆļŖźĒĢ£ ĒĢśļéśņØś BAEPsļź╝ ņ¢╗ĻĖ░ ņ£äĒĢ┤ 43.9 Hz ņ×ÉĻĘ╣ ļ╣łļÅäņÖĆ 400ĒÜīņØś ĒÅēĻĘĀĒܤņłśļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņĢĮ 9.1ņ┤ł ļ¦īņŚÉ BAEPs ĒīīĒśĢņØä ņ¢╗ņŚłĻ│Ā, ņØ┤ļź╝ ņĀüņÜ®Ē¢łņØä Ļ▓ĮņÜ░ ņ┤Ø 932ļ¬ģņØś ĒÖśņ×É ņżæ 11 ļ¬ģ (1.2 %)ņØś ĒÖśņ×ÉņŚÉņä£ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż.13 ņłśņłĀ ņżæ BAEPs ņØś ņĄ£ļīĆ ļ│ĆĒÖöļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ļČäņäØĒĢśņśĆņØä ļĢī, ĒīīĒśĢ VņØś ņśüĻĄ¼ņĀüņØĖ ņåīņŗżņØä ļ│┤ņØĖ ĒÖśņ×ÉĻ░Ć 11ļ¬ģņØ┤ņŚłļŖöļŹ░, ņØ┤ņżæ 6ļ¬ģ (54.5%)ņØ┤ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ļ│┤ņśĆĻ│Ā, ĒīīĒśĢ VņØś ņØ╝ņŗ£ņĀüņØĖ ņåīņŗżņØä ļ│┤ņØĖ ĒÖśņ×É 27ļ¬ģ ņżæ 2ļ¬ģ (7.4%), ĻĘĖļ”¼Ļ│Ā ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ 1msec ņŚ░ņן Ēś╣ņØĆ ņ¦äĒÅŁ 50% Ļ░Éņåīļź╝ ļ│┤ņØĖ ĒÖśņ×É 96ļ¬ģ ņżæ 2ļ¬ģ (2.0%)ņØś ĒÖśņ×ÉĻ░Ć ņ▓ŁļĀź ņåīņŗżļĪ£ ņØ┤ņ¢┤ņĪīļŗż (Table 2).19 ļ░śļ®┤, ĒīīĒśĢ VņØś ņ¦äĒÅŁ Ļ░Éņåī ņŚåņØ┤ ņ×Āļ│ĄĻĖ░ļ¦ī 1 msec ņØ┤ņāü ņŚ░ņן ļÉ£ ĒÖśņ×ÉļŖö ņ┤Ø 194ļ¬ģņØ┤ņŚłļŖöļŹ░, ļ¬©ļæÉ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżļĪ£ ņØ┤ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗż. ņŗ¼ņ¦Ćņ¢┤ ņØ┤ ņżæ 30ļ¬ģņØś ĒÖśņ×ÉļŖö 2 msec ņØ┤ņāüņØś ņ×Āļ│ĄĻĖ░ ņŚ░ņןņ£╝ļĪ£ ļ│┤ņśĆņ£╝ļéś, ļ¬©ļōĀ ĒÖśņ×ÉĻ░Ć ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżļĪ£ ņØ┤ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢśļŗż. ĻĘĖļōżņØĆ MVD ņżæ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ņśłņĖĪĒĢśĻĖ░ ņ£äĒĢ£ BAEPs Ļ▓ĮĻ│ä ĻĖ░ņżĆņØś ĒāĆļŗ╣ņä▒ņØä Ļ│äņé░ĒĢśņśĆĻ│Ā, ĒīīĒśĢ VņØś ņśüĻĄ¼ņĀüņØĖ ņåīņŗżņØĆ 99.4%ņØś ļåÆņØĆ ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņśĆĻ│Ā, ņØ╝ņŗ£ņĀüņØĖ ņåīņŗżņØĆ 96.7%, ņ¦äĒÅŁ 50% Ļ░Éņåīļź╝ ļÅÖļ░śĒĢ£ ņ×Āļ│ĄĻĖ░ 1 msec ņŚ░ņןņØĆ 86.5%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤░ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£, ĻĘĖļōżņØĆ Ēśäņ×¼ ĒåĄņÜ®ļÉśĻ│Ā ņ׳ļŖö ĒīīĒśĢ VņØś ņ×Āļ│ĄĻĖ░ 1 msec ņØ┤ņāü ņŚ░ņן Ēś╣ņØĆ ņ¦äĒÅŁ 50% ņØ┤ņāü Ļ░ÉņåīņØś ņĢīļ×ī ĻĖ░ņżĆņØĆ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ņśłļ░®ĒĢśļŖöļŹ░ ļČĆņĀüņĀłĒĢśļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż. ĻĘĖļ”¼Ļ│Ā, ļŹö ļéśņĢäĻ░Ć MVD ņżæ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ£ Ļ▓ĮĻ│ä ĻĖ░ņżĆņŚÉ ļīĆĒĢ┤ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ŌĆśļŗ©Ļ│äņĀü ļō▒ĻĖē (Sliding scale)ŌĆÖņØ┤ ļ│┤ļŗż ņĀüņĀłĒĢśļŗżĻ│Ā ņĀ£ņĢłĒĢśņśĆļŗż (Table 3). 1) Ļ┤Ćņ░░ ņ¦ĢĒøä (Observation sign): ĒīīĒśĢ VņØś ņ¦äĒÅŁ 50% Ļ░Éņåī ņŚåņØ┤ ņ×Āļ│ĄĻĖ░ļ¦ī 1 msec ņØ┤ņāü ņŚ░ņן; 2) Ļ▓ĮĻ│ä ņ¦ĢĒøä (Warning sign): ĒīīĒśĢ VņØś ņ¦äĒÅŁ 50% ņØ┤ņāü Ļ░ÉņåīņÖĆ ĒĢ©Ļ╗ś, ņ×Āļ│ĄĻĖ░ 1 msec ņØ┤ņāü ņŚ░ņן; 3) ņ£äĒŚś ņ¦ĢĒøä (Critical sign): ĒīīĒśĢ VņØś ņåīņŗż. MVD ņłśņłĀ ņżæ Ļ┤Ćņ░░ ņ¦ĢĒøä (observation sign)Ļ░Ć Ļ┤Ćņ░░ļÉĀ Ļ▓ĮņÜ░, Ļ▓Ćņé¼ņ×ÉļŖö ņØ┤ļź╝ ņ¦æļÅäņØśņŚÉĻ▓ī ļ░öļĪ£ ņĢīļ”¼ļéś, ņ¦æļÅäņØśĻ░Ć ņØ┤ņŚÉ ļ░śņØæĒĢśņŚ¼ ĻĄÉņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ņĪ░ņ╣śļź╝ ņĘ©ĒĢśĻĖ░ ņĢŖļŖöļŗż. ĒĢśņ¦Ćļ¦ī Ļ▓ĮĻ│ä ņ¦ĢĒøä (Warning sign) Ēś╣ņØĆ ņ£äĒŚś ņ¦ĢĒøä (Critical sign)Ļ░Ć ļ░£ņāØņŗ£ņŚÉļŖö Ļ▓Ćņé¼Ļ░Ć ņØ┤ļź╝ ļ░öļĪ£ ņ¦æļÅäņØśņŚÉĻ▓ī ņĀäļŗ¼ĒĢśĻ│Ā, ņ¦æļÅäņØśļŖö ņØ┤ņŚÉ ļ░śņØæĒĢśņŚ¼, ņ¦äĒ¢ē ņżæņØĖ ņłśņłĀņØä ņżæļŗ©ĒĢśĻ│Ā, ņØ┤ļź╝ ĻĄÉņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ņĪ░ņ╣śļź╝ ņĘ©ĒĢśļŖö Ļ▓āņØä ņĀ£ņĢłĒĢśņśĆļŗż.
LSRņØĆ ĒĢśļéśņØś ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦Ćļź╝ ņ×ÉĻĘ╣ĒĢśņśĆņØä ļĢī, ĻĘĖ ņŗĀĻ▓ĮņŚÉņä£ ņ¦Ćļ░░ļ░øļŖö ĻĘ╝ņ£Ī ļ┐É ņĢäļŗłļØ╝, Ļ░ÖņØĆ ņ¬Į ņ¢╝ĻĄ┤ņØś ļŗżļźĖ ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦ĆļĪ£ļČĆĒä░ ņ¦Ćļ░░ļ░øļŖö ĻĘ╝ņ£ĪņŚÉņä£ ņ£Āļ░£ļÉśļŖö ĒīīĒśĢņØä ļ¦ÉĒĢ£ļŗż. ņØ┤ļŖö HFSņØś ļ¦żņÜ░ ĒŖ╣ņ¦ĢņĀüņØĖ ņĀäĻĖ░ņāØļ”¼ĒĢÖņĀü ņØ┤ņāü ļ░śņØæņØ┤Ļ│Ā, HFSļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ĻĖ░ņĪ┤ņØś ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ MVD ņżæ LSRņØś ņåīņŗżņØĆ offending vessel ņØś ņĀüņĀłĒĢ£ Ļ░ÉņĢĢ ļ░Å ņłśņłĀ Ēøä ņóŗņØĆ ņśłĒøäņÖĆ ņŚ░Ļ┤Ćņä▒ņØ┤ ļåÆļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż.20,21 ņØ┤ļ¤░ ņØ┤ņ£ĀļĪ£, HFS ņŚÉ ļīĆĒĢ£ MVD ņżæ LSRņØś ņåīņŗż Ēś╣ņØĆ ņ¦äĒÅŁņØś Ļ░ÉņåīļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņŚÉ ļīĆĒĢ£ offending vesselņØś ņĀüņĀłĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīņØīņØä ļéśĒāĆļé┤ļŖö ņ¦ĆĒæ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż.21-24 ĒĢśņ¦Ćļ¦ī, ļ¬ćļ¬ć ĒÖśņ×ÉļōżņØĆ MVD ņżæ offending vesselļź╝ Ļ░ÉņĢĢĒĢśĻĖ░ ņĀäņŚÉ ņØ┤ļ»Ė LSR ņØ┤ ņåīņŗżļÉśĻ▒░ļéś, Ēś╣ņØĆ offending vesselņØä ņČ®ļČäĒ׳ Ļ░ÉņĢĢ Ē¢łņØīņŚÉļÅä, LSRņØ┤ ņé¼ļØ╝ņ¦Ćņ¦Ć ņĢŖĻ│Ā ņ¦ĆņåŹļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ņØīņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ņØ┤ļ¤░ ņØ┤ņ£ĀļĪ£ ņĀüņĀłĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīņØīņØä ņØśļ»ĖĒĢśļŖö ņ¦ĆĒæ£ļĪ£ņä£ LSRņØś ņŗżņĀ£ņĀüņØĖ Ļ░Ćņ╣śņŚÉ ļīĆĒĢ┤ ņŚ¼ņĀäĒ׳ ļģ╝ļ×ĆņØ┤ ņ׳ļŗż.21,25,26
ņØ╝ļ░śņĀüņ£╝ļĪ£ LSRņØä ĻĖ░ļĪØĒĢĀ ļĢī, ņ×ÉĻĘ╣ ņĀäĻĘ╣ņØĆ ļłł ļ░öĻ╣źĻ░Ćņןņ×Éļ”¼ņŚÉņä£ ņĢĮ 3 cm ļ¢©ņ¢┤ņ¦ä ļČĆņ£äņØś ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ņØ┤ļ¦łņŗĀĻ▓Į (frontal branch) Ēś╣ņØĆ Ļ┤æļīĆ ņŗĀĻ▓Į (zygomatic branch)ņŚÉ ņéĮņ×ģĒĢśĻ│Ā, ņ×ÉĻĘ╣ņØś ļ░®Ē¢źņØĆ ļćīņżäĻĖ░ļź╝ Ē¢źĒĢśļÅäļĪØ ņØīĻĘ╣ (Cathode)ņØ┤ ņ¢æĻĘ╣(Anode)ļ│┤ļŗż ļ│┤ļŗż ĻĘ╝ņ£äļČĆņŚÉ ņ£äņ╣śĒĢśĻ▓ī ļÉ£ļŗż.1,2 ņ×ÉĻĘ╣ņØś ņäĖĻĖ░ļŖö 5-25 mAļĪ£ ņäżņĀĢĒĢśĻ│Ā, ņ×ÉĻĘ╣ ņ¦ĆņåŹņŗ£Ļ░äņØĆ 0.3-0.5 mec ņĀĢļÅäļĪ£ ņĀüņÜ®ļÉśļ®░, ĻĖ░ļĪØ ņĀäĻĘ╣ņØĆ ņ×ģļæśļĀłĻĘ╝(orbicularis oris muscle) Ēś╣ņØĆ Ēä▒ļüØĻĘ╝ņ£Ī (mentalis muscle)ņŚÉ ņéĮņ×ģĒĢśņŚ¼ ņĖĪņĀĢĒĢ£ļŗż. ņ£äņÖĆ Ļ░ÖņØ┤ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ņ£äņ¬Į ļČäņ¦Ć(upper branch)ņØś ņĢäļŗī ņĢäļלņ¬Į ļČäņ¦Ć (lower branch)ļź╝ ņ×ÉĻĘ╣ĒĢ┤ļÅä LSRņØ┤ ņ£Āļ░£ļÉĀ ņłś ņ׳ļŖöļŹ░, ņĢäļלņ¬Į ļČäņ¦Ćļź╝ ņ×ÉĻĘ╣ĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö, ļ│╝ ņŗĀĻ▓Į(buccal branch) Ēś╣ņØĆ Ēä▒ Ļ░Ćņןņ×Éļ”¼ ņŗĀĻ▓Į (mandibular marginal branch)ņŚÉ ņ×ÉĻĘ╣ ņĀäĻĘ╣ņØä ļæÉĻ│Ā, ņØ┤ļ¦łĻĘ╝ņ£Ī (frontalis muscle) Ēś╣ņØĆ ļłłļæśļĀłĻĘ╝ņ£Ī (orbicularis oculi muscle)ņŚÉņä£ LSR ņĖĪņĀĢņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņé¼ļ×īļ¦łļŗż ņ¢╝ĻĄ┤ ņŗĀĻ▓ĮņØś ļČäņ¦ĆļŖö ļ¦żņÜ░ ļŗżņ¢æĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.27,28 ĻĘĖļ¤¼ļ»ĆļĪ£, ĒÖśņ×Éļōż Ļ░äņØś ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦ĆņØś ĒĢ┤ļČĆĒĢÖņĀü ļ│ĆņØ┤ļź╝ Ļ│ĀļĀżĒĢśņŚ¼, ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦Ćļź╝ ļ│┤ļŗż ņĀĢĒÖĢĒĢśĻ▓ī ņ×ÉĻĘ╣ĒĢĀ ļĢī, LSR ļśÉĒĢ£ ļ│┤ļŗż ņĀĢĒÖĢĒĢśĻ▓ī ņ¢╗ņØä ņłś ņ׳ļŗż. ĻĄŁļé┤ņØś ĒĢ£ ņŚ░ĻĄ¼ņ¦äļōżņØĆ ņØ┤ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤, ņłśņłĀ ņĀä ņÖĖļל Ļ▓Ćņé¼ņŗżņŚÉņä£ LSR ņĖĪņĀĢĒĢśņŚ¼ LSR ņØ┤ Ļ░Ćņן ņל ņ£Āļ░£ļÉśļŖö ņ¢╝ĻĄ┤ ņŗĀĻ▓Į ļČäņ¦ĆņØś ņ£äņ╣śļź╝ ĒÖĢņØĖĒĢśņŚ¼, ņ¢╝ĻĄ┤ņŗĀĻ▓Į ļČäņ¦Ćļź╝ ņ¦ĆļÅäĒÖö(mapping) ĒĢśņśĆĻ│Ā, ņØ┤ļź╝ Ļ│ĀļĀżĒĢśņŚ¼ IONMļź╝ ņŗ£Ē¢ēĒĢśņśĆņØä ļĢī, LSRņØś ĒÜ©ņ£©ņØ┤ ļ│┤ļŗż ļåÆņØ╝ ņłś ņ׳ļŗżĻ│Ā ļ░£Ēæ£ĒĢśņśĆļŗż.29 ļśÉĒĢ£, ĻĘĖļōżņØĆ ņ×ÉĻĘ╣ņØś ļ░®Ē¢źņØä ļćīņżäĻĖ░ņÖĆ ļ®Ćņ¢┤ņ¦ĆļŖö ļ▒ĪĒ¢ź (ņØīĻĘ╣ņØ┤ ņ¢æĻĘ╣ļ│┤ļŗż ļ│┤ļŗż ņøÉņ£äļČĆ)ņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśņśĆļŖöļŹ░ (Fig 2), ņ×ÉĻĘ╣ ļ░®Ē¢źņØä ņØ┤ņÖĆ Ļ░ÖņØ┤ ļ░śļīĆļĪ£ ņŗ£Ē¢ēĒĢśņŚ¼ ļ│ĄĒĢ®ĻĘ╝ņ£ĪĒÖ£ļÅÖņĀäņ£ä(Compound muscle action potential)ļź╝ ĒÖĢņØĖĒĢśļ®┤ņä£ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮļČäņ¦Ćļź╝ ņĀüņĀłĒĢśĻ▓ī ņ×ÉĻĘ╣ĒĢĀ ņłś ņ׳ņŚłĻ│Ā, LSRņØś ĒÜ©ņ£© ļśÉĒĢ£ ļåÆņØ╝ ņłś ņ׳ņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.
LSRļź╝ ņØ┤ņÜ®ĒĢ£ IONM ņØĆ offending vesselņØä ĒÖĢņØĖĒĢśĻ│Ā, ņĢłļ®┤ņŗĀĻ▓ĮņŚÉ ļīĆĒĢ┤ offending vesselņØś ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīļŖöņ¦Ć ĒÖĢņØĖĒĢśļŖö ņ£ĀņÜ®ņä▒ Ļ▓Ćņé¼ ļ░®ļ▓ĢņØ┤ļŗż.30 ņØ╝ļČĆ ņĀĆņ×ÉļŖö LSRņØ┤ ņÖäņĀäĒ׳ ņé¼ļØ╝ņ¦Ćņ¦Ć ņĢŖļŖöļŗż ĒĢ┤ļÅä, LSRņØś ņ¦äĒÅŁņØ┤ Ļ░ÉņĢĢ ņĀäļ│┤ļŗż Ļ░ÉņåīĒĢśļŖö Ļ▓āļÅä ņóŗņØĆ ņśłĒøäņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.31 ļśÉĒĢ£, ļŗżļźĖ ņØ╝ļČĆ ņŚ░ĻĄ¼ņ×ÉļōżņØĆ HFSņØś ĒśĖņĀäĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņןĻĖ░ņĀüņØĖ ņśłĒøä (long-term outcome)Ļ│╝ MVD ņżæ LSR ņåīņŗżĻ│╝ļŖö ņŚ░Ļ┤Ćņä▒ņØ┤ ņĀüņ¢┤, LSR ĒÜ©ņÜ®ņä▒ņŚÉ ļīĆĒĢ┤ ņØśļ¼ĖņØä ņĀ£ĻĖ░ĒĢśņśĆļŗż.32 ĻĘĖļōżņØĆ MVDļź╝ ņŗ£Ē¢ēĒĢ£ 72ļ¬ģņØś HFS ĒÖśņ×Éļź╝ ļČäņäØĒĢśņśĆļŖöļŹ░, ņØ┤ ņżæ 40ļ¬ģņØ┤ MVD ņżæ LSR ņØ┤ ņåīņŗżļÉśņŚłņ¦Ćļ¦ī, Ēć┤ņøÉĒĢĀ ļĢī 5ļ¬ģņØĆ Ļ▓Įļ»ĖĒĢ£ HFSņØ┤ ņ¦ĆņåŹļÉśņŚłĻ│Ā, ņØ┤ ņżæ 4ļ¬ģņØĆ 6Ļ░£ņøö ļÆż ņČöņĀüņŗ£ņŚÉļÅä ņ”ØņāüņØ┤ ņ¦ĆņåŹļÉśņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Thirumala ļō▒ļÅä MVD ņżæ LSRņØś ņåīņŗżņØ┤ HFSņØś ļŗ©ĻĖ░ņĀüņØĖ ņśłĒøäņÖĆļŖö ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņ¦Ćļ¦ī, ņØ╝ļČĆ ĒÖśņ×ÉņŚÉņä£ļŖö LSRņØ┤ ņåīņŗżļÉśņ¦Ć ņĢŖņĢäļÅä ņןĻĖ░ņĀüņ£╝ļĪ£ ņČöņĀüĒĢśņśĆņØä ļĢī, HFSņØ┤ ĒśĖņĀäļÉĀ ņłś ņ׳ļŗżĻ│Ā ņĀ£ņŗ£ĒĢśļ®░, MVD ņżæ LSR ņåīņŗżĻ│╝ ņןĻĖ░ņĀüņØĖ ņśłĒøäņÖĆļŖö ņŚ░Ļ┤Ćņä▒ņØ┤ ņĀüļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.33
ņØ┤ļ¤░ ņ×öļźś LSR (residual LSR) ņØĆ HFSņØś ļ│æļ”¼ ĻĖ░ņĀä ņżæ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄņØś Ļ│╝ĒĢŁņ¦äņä▒ (hyperexcitability)ļź╝ ĒżĒĢ©ĒĢśļŖö ņżæņČöņä▒ ĻĖ░ņĀä (central mechanism)ļź╝ ļÆĘļ░øņ╣©ĒĢśļŖö ņ”ØĻ▒░ņØ┤ļŗż.4,5 MVDļź╝ ĒåĄĒĢ┤ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņŚÉ ļīĆĒĢ£ offending vesselņØś ņ¦üņĀæņĀüņØĖ ņĢĢļ░Ģ ļ¼ĖņĀ£ļŖö ĒĢ┤Ļ▓░ļÉśņŚłņ¦Ćļ¦ī, ņ¢╝ĻĄ┤ ņŗĀĻ▓ĮĒĢĄņØś ļ│Ćņä▒ļÉ£ Ļ│╝ĒĢŁņ¦äņä▒ņØ┤ ņĀĢņāüĒÖöļÉśļŖöļŹ░ ņłś Ļ░£ņøö Ēś╣ņØĆ ņłś ļģäņØś ņŗ£Ļ░äņØ┤ Ļ▒Ėļ”¼ļ»ĆļĪ£, ĻĘĖ ĻĖ░Ļ░ä ļÅÖņĢł ņØ╝ļČĆ ĒÖśņ×ÉņŚÉņä£ ņ×öļźś LSR ņØ┤ Ļ┤Ćņ░░ļÉśĻ│Ā, HFS ņ”ØņāüņØ┤ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£, MVD ņżæ offending vesselņØä ĒÖĢņØĖĒĢśĻ│Ā, ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīļŖöņ¦Ć ņĢīņĢäļ│┤ļŖö ņ¦ĆĒæ£ļĪ£ LSRļź╝ ĒÖ£ņÜ®ĒĢśņ¦Ćļ¦ī, MVD ņżæ Ļ┤Ćņ░░ļÉśļŖö LSRņØś ļ│ĆĒÖö (ņåīņŗż Ēś╣ņØĆ ņ×öļźś)ļź╝ ĒĢ┤ņäØĒĢĀ ļĢī, Ļ▓Ćņé¼ņ×ÉņÖĆ ņ¦æļÅäņØś Ļ░äņŚÉ ĻĖ┤ļ░ĆĒĢśĻ▓ī ņåīĒåĄĒĢśļ®░, ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØä ņØ┤ļŻ©ņ¢┤Ļ░ĆļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż.
Z-L ļ░śņØæ (ZLR)ņØĆ HFSņŚÉ MVD ņłśņłĀņØä ĒĢĀ ļĢī, LSR Ļ│╝ ļŹöļČłņ¢┤ offending vesselņØä ĒÖĢņØĖ ļ░Å Ļ░ÉņĢĢ ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢśļŖö Ļ▓Ćņé¼ļ░®ļ▓Ģņ£╝ļĪ£, ņØ┤ļŖö offending vesselņØś ļ▓ĮņØä ņĀäĻĖ░ļĪ£ ņ×ÉĻĘ╣ĒĢĀ ļĢī ņ£Āļ░£ļÉśļŖö ļ░śņØæņØ┤ļŗż.34,35 ZLRņØĆ REZņŚÉ ņ£äņ╣śĒĢ£ offending vesselņØś ļ▓ĮņØä ņ×ÉĻĘ╣ĒĢśņŚ¼, ņØĖņĀæĒĢ£ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØ┤ ĒĢ©Ļ╗ś ņ×ÉĻĘ╣ļÉśņ¢┤ ņ£Āļ░£ļÉśļŖö ĻĘ╝ņĀäļÅä ļ░śņØæņØ┤ĻĖ░ņŚÉ, offending vesselņØś Ļ░ÉņĢĢņØ┤ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĪīņØä Ļ▓ĮņÜ░, ļ░öļĪ£ ņåīņŗżļÉ£ļŗż. ņĢ×ļČĆļČäņŚÉņä£ ņ¢ĖĻĖēĒ¢łļō»ņØ┤, ņØ╝ļČĆ HFS ĒÖśņ×ÉņŚÉņä£ļŖö LSRņØ┤ offending vesselņØä Ļ░ÉņĢĢĒĢśĻĖ░ ņĀäņŚÉ ņåīņŗżļÉśĻ▒░ļéś, ļ░śļīĆļĪ£ ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØ┤ ņŗ£Ē¢ēĒ¢łņØīņŚÉļÅä LSRņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉĀ Ļ▓ĮņÜ░Ļ░Ć ņ׳ļŗż. ņØ┤ļ¤░ Ļ▓ĮņÜ░ LSRļ¦ī ļŗ©ļÅģņ£╝ļĪ£ ņØśņĪ┤ĒĢĀ Ļ▓ĮņÜ░ IONMļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓ĮņÜ░ offending ĒÖĢņØĖĒĢśĻ▒░ļéś, ņČ®ļČäĒĢ£ Ļ░ÉņĢĢ ņŚ¼ļČĆļź╝ ĒīÉļŗ©ĒĢśļŖöļŹ░ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż. ļśÉĒĢ£ ņØ╝ļČĆ ĒÖśņ×ÉļŖö offending vesselņØ┤ 1Ļ░£ ņĢäļŗī 2Ļ░£ ņØ┤ņāüņØ╝ ņłś ņ׳ļŗż. ņØ┤ņ▓śļ¤╝ LSRļź╝ ņØ┤ņÜ®ĒĢśļŖöļŹ░ ĒĢ£Ļ│äĻ░Ć ņ׳ņØä Ļ▓ĮņÜ░, MVD ņŗ£ ZLRļź╝ ļ│æĒĢ®ĒĢśļ®┤, offending vesselļź╝ ļ│┤ļŗż ĒÖĢņŗżĒĢśĻ▓ī ĒÖĢņØĖĒĢśĻ│Ā, Ļ░ÉņĢĢņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳Ļ▓ī ļÉ£ļŗż.
ĻĖ░ļĪØņĀäĻĘ╣ņØĆ ļłłļæśļĀłĻĘ╝ņ£Ī, ņ×ģļæśļĀł ĻĘ╝ņ£Ī ĻĘĖļ”¼Ļ│Ā Ēä▒ļüØĻĘ╝ņ£ĪņŚÉ ņéĮņ×ģĒĢ£ļŗż. ņ×ÉĻĘ╣ņĀäĻĘ╣ņØĆ ļæÉĻ░£Ļ░Ģļé┤ ņłśņłĀņŚÉņä£ ņé¼ņÜ®ļÉśļŖö ļ╣äņ╣©ņŖĄĒśĢ ļÅÖņŗ¼ĒśĢ ņĀäĻĘ╣(concentric electrode)ņØä ņé¼ņÜ®ĒĢśĻ│Ā, ņ¢æĻĘ╣ļ░®ņŗØ(bi-polar mode)ņØś ņ×ÉĻĘ╣ņØ┤ Ļ░ĆļŖźĒĢśļÅäļĪØ ĒĢ£ļŗż. ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņŚÉņä£ offending vesselņØä Ļ░ÉņĢĢĒĢśĻĖ░ ņĀäņŚÉ, ņ×ÉĻĘ╣ņĀäĻĘ╣ņØä REZņØś ņĀæņ┤ēļČĆņ£äņØś 5mm ņĢłņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö offending vesselņŚÉ ņ£äņ╣śņŗ£ĒéżĻ│Ā, ņĀäĻĖ░ņ×ÉĻĘ╣ (1-2mA, 0.2msec)ņØä ņĢĮ 3 Hz ņåŹļÅäļĪ£ ņ×ÉĻĘ╣ĒĢĀ ļĢī, ĒĢ┤ļŗ╣ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮļČäņ¦ĆņŚÉņä£ ņ¦Ćļ░░ļ░øļŖö ĻĘ╝ņ£ĪņŚÉņä£ ĻĘ╝ņĀäļÅä ĒīīĒśĢņØ┤ ņ£Āļ░£ļÉ£ļŗż. Offending vesselņØä ĒÖĢņØĖĒĢśĻ│Ā, ņÖäņĀäĒ׳ Ļ░ÉņĢĢĒĢĀ ļĢīĻ╣īņ¦Ć, ņ£äņØś ņ×æņŚģņØä ļ░śļ│ĄĒĢśĻ│Ā, offending vesselņŚÉ ļīĆĒĢ£ ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćļ®┤, ZLRņØĆ ļŹö ņØ┤ņāü ņ£Āļ░£ļÉśņ¦Ć ņĢŖĻ▓ī ļÉ£ļŗż.
ZLRņØĆ ņĢ×ņä£ ņ¢ĖĻĖēĒ¢łļō»ņØ┤ LSRņØä ĒÖ£ņÜ®ĒĢśĻĖ░ ņ¢┤ļĀżņÜĖ Ļ▓ĮņÜ░ ļ¦żņÜ░ ņ£ĀņÜ®ĒĢ£ Ļ▓Ćņé¼ļ░®ļ▓ĢņØ┤ļŗż. Zheng ļō▒ņØĆ LSRĻ│╝ ZLRļź╝ ļ│ĄĒĢ®ĒĢ┤ņä£ ņŗ£Ē¢ēĒĢĀ Ļ▓ĮņÜ░, LSRļ¦ī ļŗ©ļÅģņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓āļ│┤ļŗż ņ£ĀņÜ®ĒĢśļŗżĻ│Ā ņĀ£ņĢłĒĢśņśĆļŗż. ļśÉĒĢ£, ZLRņØĆ offending vesselņØ┤ 2Ļ░£ ņØ┤ņāüņØś ņŚ¼ļ¤¼ Ļ░£Ļ░Ć ņØśņŗ¼ļÉĀ ļĢī, offending vesselņØä ĒÖĢņØĖĒĢśļŖöļŹ░, ĒŖ╣Ē׳ ņ£ĀņÜ®ĒĢśļŗż. ĻĘĖļ¤¼ļéś, ZLRņØĆ ņé¼ņÜ®ĒĢĀ ļĢī, ļ¬ć Ļ░Ćņ¦Ć ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż. ZLRņØĆ offending vesselņØä ņ×ÉĻĘ╣ĒĢ£ ļÆż, ņØĖņĀæĒĢ£ ņ¢╝ĻĄ┤ņŗĀĻ▓Įņ£╝ļĪ£ ņĀäĻĖ░ņ×ÉĻĘ╣ņØ┤ ņĀäļŗ¼ļÉśņ¢┤ ņ£Āļ░£ļÉśļŖö ļ░śņØæņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ, REZņØś HFS ļ│æļ│Ć ņ£äņ╣ś ņÖĖņŚÉļÅä offending vesselĻ│╝ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ņĀæņ┤ēņØ┤ ņ׳ļŗżļ®┤, ZLRņØĆ ņ£Āļ░£ļÉĀ ņłś ņ׳ļŗż.36 ņśłļź╝ ļōżņ¢┤, REZņØś ņĀæņ┤ēļČĆņ£ä ļ┐É ņĢäļŗłļØ╝, offending vesselņØś ļ¦Éļŗ© ļČĆņ£äņÖĆ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ļ¦Éļŗ©ļČĆņ£äņØś ņĀæņ┤ēņØ┤ ņ׳ņØä Ļ▓ĮņÜ░, offending vesselņØś ņČ®ļČäĒĢ£ Ļ░ÉņĢĢņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā, LSRņØ┤ ņåīņŗżļÉśņ¢┤ļÅä, ZLRņØĆ ņé¼ļØ╝ņ¦Ćņ¦Ć ņĢŖĻ│Ā ņ¦ĆņåŹļÉĀ ņłś ņ׳ļŗż.
ņ¢╝ĻĄ┤ņŗĀĻ▓Į F Ēīī Ļ▓Ćņé¼ļŖö ņ¢╝ĻĄ┤ ņŗĀĻ▓ĮņØä ņĀäĻĖ░ņ×ÉĻĘ╣ Ē¢łņØä ļĢī, ļćīņżäĻĖ░ļ░®Ē¢źņ£╝ļĪ£ ņĀäļŗ¼ļÉ£ ņ×ÉĻĘ╣ņØ┤ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄĻ╣īņ¦Ć ņĀäļŗ¼ļÉ£ Ēøä, ļŗżņŗ£ ļ░śļīĆ ļ░®Ē¢źņ£╝ļĪ£ ņ¢╝ĻĄ┤ņŗĀĻ▓Įņ£╝ļĪ£ ĒåĄĒĢ┤ ņĀäļŗ¼ļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņ¦ĆņŚ░ņä▒ ĻĘ╝ņĀäļÅä ĒīīĒśĢņØ┤ļŗż. F Ēīī ĒÖ£ļÅÖņØĆ ņÜ┤ļÅÖņŗĀĻ▓ĮņØś ĒØźļČäņä▒ņØä ļéśĒāĆļé┤ļŖö ņ¦ĆĒæ£ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā,37 ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØä ņ×ÉĻĘ╣ĒĢśņśĆņØä ļĢīļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄņ£╝ļĪ£ ĒżĒĢ©ĒĢśņŚ¼ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮņØś ĒØźļČäņä▒ņØä ĻĖ░ļĪØĒĢĀ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ņŗżņĀ£ HFS ĒÖśņ×ÉņŚÉļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓Į F Ēīī Ļ▓Ćņé¼ ņŗ£Ē¢ēĒĢĀ ļĢī, MVD ņŗ£Ē¢ē ņĀäņŚÉļŖö ņ”ØņāüņØ┤ ņ׳ļŖö ņ¬ĮņŚÉņä£ ņ”ØņāüņØ┤ ņŚåļŖö ņ¬Įļ│┤ļŗż FĒīīĻ░Ć ļŹö ņ×ÉņŻ╝ ņ£Āļ░£ļÉśņŚłĻ│Ā, MVD ņŗ£Ē¢ē Ēøä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ņé¼ļØ╝ņ¦ĆļŖö Ļ▓āņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.38 ņ¢╝ĻĄ┤ņŗĀĻ▓Į FĒīī Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ļĢīļŖö ņ¦üņĀæņĀüņ£╝ļĪ£ ņ£Āļ░£ļÉśļŖö MĒīīņÖĆ Ļ▓╣ņ╣©ņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤, ĻĖ░ļĪØņĀäĻĘ╣ņØĆ Ēä▒ļüØĻĘ╝ņ£Ī (mentalis muscle)ņŚÉ ņéĮņ×ģĒĢśĻ│Ā, ņ×ÉĻĘ╣ ņĀäĻĘ╣ņØĆ Ēä▒ Ļ░Ćņןņ×Éļ”¼ ņŗĀĻ▓Į (mandibular marginal branch)ņØś ļ¦Éļŗ© ļČĆņ£äņŚÉ ņ£äņ╣śņŗ£ņ╝£ ņ£Āļ░£ĒĢ£ļŗż.
ĒØöĒ׳ ņŗ£Ē¢ēļÉśņ¦Ćļ¦ī, Ļ▓ĮļæÉĻ░£ ņĀäĻĖ░ņ×ÉĻĘ╣ (transcranial electric stimulation)ņØä ĒåĄĒĢ┤ ņ¢╗ņ¢┤ņ¦ä ņ¢╝ĻĄ┤ņÜ┤ļÅÖņ£Āļ░£ņĀäņ£ä (facial MEP)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ MVD ņżæ HFSņØś ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄņØś ĻĖ░ļŖźņĀü ņåŹņä▒ņØä ņĖĪņĀĢĒĢĀ ņłś ņ׳ļŗż. HFS ĒÖśņ×ÉņŚÉņä£ ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄņØś Ļ│╝ĒĢŁņ¦äņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ Ļ▓ĮļæÉĻ░£ņĀäĻĖ░ņ×ÉĻĘ╣ņØä ņŗ£Ē¢ēĒĢĀ ļĢī, ļ│æļ│ĆņĖĪņŚÉņä£ facial MEPņØś ņ¦äĒÅŁĻ│╝ ņ¦ĆņåŹņŗ£Ļ░äņØ┤ ļ╣äļ│æļ│ĆņĖĪĻ│╝ ļ╣äĻĄÉņŗ£ ĒĢŁņ¦äļÉśņ¢┤ ņ׳Ļ│Ā, facial MEPļź╝ ņ£Āļ░£ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚŁņ╣ś (threshold) ļśÉĒĢ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│Ā ļÉśņŚłļŗż.39,40 ļśÉĒĢ£, MVDļź╝ ĒåĄĒĢ┤ offending vesselņØś Ļ░ÉņĢĢņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░, facial MEPņØś ņ¦äĒÅŁ ļ░Å ņ¦ĆņåŹņŗ£Ļ░äņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉ£ļŗżĻ│Ā ļ│┤Ļ│Ā ļÉśņŚłļŗż.
HFSņŚÉ ļīĆĒĢ┤ MVD ņŗ£Ē¢ēĒĢĀ ļĢī, CN VIIIņØś ņåÉņāüņ£╝ļĪ£ ņØĖĒĢ£ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØĆ Ļ░Ćņן ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”Ø ņżæ ĒĢśļéśņśĆņ£╝ļéś, BAEPsļź╝ ņØ┤ņÜ®ĒĢ£ IONMņ£╝ļĪ£ ļ░£ņāØļźĀņØä Ēü¼Ļ▓ī Ļ░ÉņåīĒĢśĻ▓ī ļÉśņŚłļŗż. IONMņŚÉ ļīĆĒĢ£ Ļ▓ĮĒŚśĻ│╝ ņ¦ĆņŗØņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£, Ļ│╝Ļ▒░ņŚÉ ļ╣äĒĢ┤ ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗżņØä ļ│┤ļŗż Ļ░Éņåīņŗ£ĒéżĻĖ░ ņ£äĒĢ£ BAEPsņØś Ļ▓Ćņé¼ļ░®ļ▓Ģ ļ░Å Ļ▓ĮĻ│äĻĖ░ņżĆ ļō▒ņŚÉ ļ¦ÄņØĆ ļ│ĆĒÖöĻ░Ć ņ׳ņ¢┤ ņÖöļŗż. ļśÉĒĢ£, HFSņØś ĒŖ╣ņ¦ĢņĀüņØĖ ņĀäĻĖ░ņāØļ”¼ĒĢÖņĀü ļ░śņØæņØĖ LSRņŚÉ ļīĆĒĢ┤ņä£ļÅä Ļ▓Ćņé¼ ļ░®ļ▓ĢņØś ļ│ĆĒÖöĻ░Ć ņ׳ņŚłĻ│Ā, MVD ņŗ£Ē¢ē ĒøäņŚÉļÅä ņ¦ĆņåŹļÉśļŖö ņ×öļźś LSRņØś ņØśļ»ĖņŚÉ ļīĆĒĢ┤ņä£ļÅä HFSņØś ļ│æļ”¼ĻĖ░ņĀäĻ│╝ ĒĢ©Ļ╗ś ļ¦ÄņØĆ ņ¦äļ│┤Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĪīļŗż. ļśÉĒĢ£, LSR ļ┐Éļ¦ī ņĢäļŗłļØ╝, HFSņØś offending vesselņØä ĒÖĢņØĖĒĢśĻ▒░ļéś ņČ®ļČäĒĢ£ Ļ░ÉņĢĢ ņŚ¼ļČĆ ĒīÉļŗ©ņŚÉ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ļŖö Z-L ļ░śņØæņØ┤ļØ╝ļŖö Ļ▓Ćņé¼ļ░®ļ▓ĢņØ┤ Ļ░£ļ░£ļÉśņ¢┤ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳Ļ│Ā, ņ¢╝ĻĄ┤ņŗĀĻ▓ĮĒĢĄņØś Ļ│╝ĒĢŁņ¦äņä▒ņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŖö ņ¢╝ĻĄ┤ņŗĀĻ▓Į FĒīī Ļ▓Ćņé¼ņÖĆ ņ¢╝ĻĄ┤ņÜ┤ļÅÖņ£Āļ░£ņĀäņ£äņØś ņ£ĀņÜ®ņä▒ ļśÉĒĢ£ ņ×ģņ”ØļÉśņ¢┤ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņ▓śļ¤╝ ļŗżņ¢æĒĢ£ IONM Ļ▓Ćņé¼ļ░®ļ▓ĢĻ│╝ ņØśļ»ĖņŚÉ ļīĆĒĢ£ ņ¦ĆņŗØĻ│╝ ņØ┤ĒĢ┤ļź╝ ĒåĄĒĢ┤, HFSņŚÉ MVD ņłśņłĀņØĆ ļ│┤ļŗż ņĢłņĀĢĒĢśĻ│Ā, ĒÜ©Ļ│╝ņĀüņØĖ ņłśņłĀļ░®ļ▓Ģņ£╝ļĪ£ ļ░£ņĀäĒĢ┤Ļ░ł ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
Fig.┬Ā1.
Example of consecutive IONM of the BAEPs using a stimulation rate of 10 Hz/sec and 1000 averaging times: (A) First BAEPs showing minimal wave V change; (B) Second BAEPs showing a slight change in wave V (the latency of wave V was delayed by 0.70 msec with a minimal decrease in the amplitude); (C) Third BAEPs showing that the wave V latency was delayed by 1.44 msec and the wave V amplitude decreased by about 70%; IONM: Intraoperative neurophysiological monitoring; BAEPs: Brainstem auditory evoked potentials
Gray line: Baseline BAEPs; Black line: Obtained BAEPs.
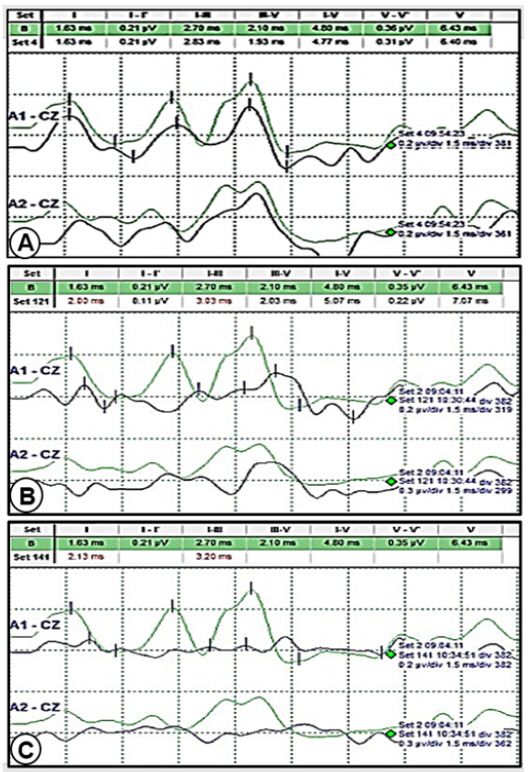
Fig.┬Ā2.
A: Facial nerve mapping performed preoperatively. The locations of maximal LSR elicitation were divided into three regions: F (the direction towards the frontalis muscle, which was almost vertical with respect to the anode), O (the direction towards the orbicularis oculi muscle), and F-O (in between F and O). B: The direction of stimulation in the conventional and the new methods. In the conventional method, electrodes are placed in the temporal or zygomatic branch of the facial nerve, about 3 cm lateral to the lateral margin of the orbit, and centripetal impulses are transmitted towards the brainstem with the cathode positioned proximally (Black arrow). In contrast, electrodes were inserted intradermally with the anode located proximally over the area just anterior to the mandibular fossa and the cathode located distally in the temporal branch of the facial nerve in the new method (Red arrow) The direction of stimulation was centrifugal outwards from the brainstem. LSR: Lateral spread response, S: Stimulator.

Table┬Ā1.
Comparison of the Protocol of BAEPs and Postoperative Hearing Loss
| BAEPs | ņØ┤ņĀä ļ░®ņŗØa | Ēśäņ×¼ ļ░®ņŗØb | p value |
|---|---|---|---|
| ņ×ÉĻĘ╣ļ╣łļÅä (Stimulus rate) | 26.9 Hz | 43.9 Hz | |
| ĒÅēĻĘĀĒÖöĒܤņłś (Averaging trials) | 1000-2000 ĒÜī | 400 ĒÜī | |
| 1ĒÜī BAEPs ņ¢╗ļŖöļŹ░ Ļ▒Ėļ”¼ļŖö ņŗ£Ļ░ä | ņĢĮ 37.1 -74.3 ņ┤ł | ņĢĮ 9.1 ņ┤ł | |
| ĒīīĒśĢ VņØś Ļ▓ĮĻ│ä ĻĖ░ņżĆ (Warning criteria) | 1 ms latency prolongation or a 50% decrease in amplitude | 50% decrease in amplitude | |
| ņłśņłĀ Ēøä ņ▓ŁļĀź ņåīņŗż | 0.0402 | 0.0039 | 0.002 |
Table┬Ā2.
Comparison of Postoperative Hearing Loss According to the Maximal Changes of BAEPs
Group A: no significant changes, Group B: greatest latency prolongation greater than 1 ms without amplitude reduction greater than 50%, Group C: amplitude reduction greater than 50% without greatest latency prolongation greater than 1 ms, Group D: greatest latency prolongation greater than 1.0 ms and amplitude reduction greater than 50%; Group E: transient loss of wave V; and Group F: Permanent loss of wave V.
Table┬Ā3.
The Sliding Scale of Warning Criteria of BAEPs
References
1. Nielsen VK: Pathophysiology of hemifacial spasm: I. Ephaptic transmission and ectopic excitation. Neurology 1984;34:418-426.
2. Moller AR, Jannetta PJ: Hemifacial spasm: results of electrophysiologic recording during microvascular decompression operations. Neurology 1985;35:969-974.


4. Moller AR: Vascular compression of cranial nerves: II: pathophysiology. Neurol Res 1999;21:439-443.


5. Moller AR, Jannetta PJ: Microvascular decompression in hemifacial spasm: intraoperative electrophysiological observations. Neurosurgery 1985;16:612-618.


6. Barker FG, Jannetta PJ, Bissonette DJ, Shields PT, Larkins MV, Jho HD: Microvascular decompression for hemifacial spasm. J Neurosurg 1995;82:201-210.


7. Sindou M, Mercier P: Microvascular decompression for hemifacial spasm: Surgical techniques and intraoperative monitoring. Neurochirurgie 2018;64:133-143.


8. Legatt AD: Mechanisms of intraoperative brainstem auditory evoked potential changes. J Clin Neurophysiol 2002;19:396-408.


9. Acevedo JC, Sindou M, Fischer C, Vial C: Microvascular decompression for the treatment of hemifacial spasm. Retrospective study of a consecutive series of 75 operated patients--electrophysiologic and anatomical surgical analysis. Stereotact Funct Neurosurg 1997;68:260-265.

10. Legatt AD: Electrophysiology of Cranial Nerve Testing: Auditory Nerve. J Clin Neurophysiol 2018;35:25-38.


11. American Clinical Neurophysiology S: Guideline 9C: Guidelines on short-latency auditory evoked potentials. J Clin Neurophysiol 2006;23:157-167.


12. Martin WH, Stecker MM: ASNM position statement: intraoperative monitoring of auditory evoked potentials. J Clin Monit Comput 2008;22:75-85.


13. Joo BE, Park SK, Cho KR, Kong DS, Seo DW, Park K: Real-time intraoperative monitoring of brainstem auditory evoked potentials during microvascular decompression for hemifacial spasm. J Neurosurg 2016;125:1061-1067.


14. James ML, Husain AM: Brainstem auditory evoked potential monitoring: when is change in wave V significant? Neurology 2005;65:1551-1555.


15. Polo G, Fischer C, Sindou MP, Marneffe V: Brainstem auditory evoked potential monitoring during microvascular decompression for hemifacial spasm: intraoperative brainstem auditory evoked potential changes and warning values to prevent hearing loss--prospective study in a consecutive series of 84 patients. Neurosurgery 2004;54:97-104; discussion 104.


16. Grundy BL, Jannetta PJ, Procopio PT, Lina A, Boston JR, Doyle E: Intraoperative monitoring of brain-stem auditory evoked potentials. J Neurosurg 1982;57:674-681.


17. Hatayama T, Moller AR: Correlation between latency and amplitude of peak V in the brainstem auditory evoked potentials: intraoperative recordings in microvascular decompression operations. Acta Neurochir (Wien) 1998;140:681-687.


18. Thirumala PD, Carnovale G, Habeych ME, Crammond DJ, Balzer JR: Diagnostic accuracy of brainstem auditory evoked potentials during microvascular decompression. Neurology 2014;83:1747-1752.


19. Park SK, Joo BE, Lee S, et al: The critical warning sign of real-time brainstem auditory evoked potentials during microvascular decompression for hemifacial spasm. Clin Neurophysiol 2018;129:1097-1102.


20. Kong DS, Park K, Shin BG, Lee JA, Eum DO: Prognostic value of the lateral spread response for intraoperative electromyography monitoring of the facial musculature during microvascular decompression for hemifacial spasm. J Neurosurg 2007;106:384-387.

21. Kim CH, Kong DS, Lee JA, Kwan P: The potential value of the disappearance of the lateral spread response during microvascular decompression for predicting the clinical outcome of hemifacial spasms: a prospective study. Neurosurgery 2010;67:1581-1587; discussion 1587.

22. Huang BR, Chang CN, Hsu JC: Intraoperative electrophysiological monitoring in microvascular decompression for hemifacial spasm. J Clin Neurosci 2009;16:209-213.


23. Sekula RF, Bhatia S, Frederickson AM, et al: Utility of intraoperative electromyography in microvascular decompression for hemifacial spasm: a meta-analysis. Neurosurg Focus 2009;27:E10.


24. Thirumala PD, Shah AC, Nikonow TN, et al: Microvascular decompression for hemifacial spasm: evaluating outcome prognosticators including the value of intraoperative lateral spread response monitoring and clinical characteristics in 293 patients. J Clin Neurophysiol 2011;28:56-66.


25. Tobishima H, Hatayama T, Ohkuma H: Relation between the persistence of an abnormal muscle response and the long-term clinical course after microvascular decompression for hemifacial spasm. Neurol Med Chir (Tokyo) 2014;54:474-482.


26. Hatem J, Sindou M, Vial C: Intraoperative monitoring of facial EMG responses during microvascular decompression for hemifacial spasm. Prognostic value for long-term outcome: a study in a 33-patient series. Br J Neurosurg 2001;15:496-499.
27. Katz AD, Catalano P: The clinical significance of the various anastomotic branches of the facial nerve. Report of 100 patients. Arch Otolaryngol Head Neck Surg 1987;113:959-962.

28. Kopuz C, Turgut S, Yavuz S, Ilgi S: Distribution of facial nerve in parotid gland: analysis of 50 cases. Okajimas Folia Anat Jpn 1994;70:295-299.


29. Lee S, Park SK, Lee JA, et al: A new method for monitoring abnormal muscle response in hemifacial spasm: A prospective study. Clin Neurophysiol 2018;129:1490-1495.


30. Mooij JJ, Mustafa MK, van Weerden TW: Hemifacial spasm: intraoperative electromyographic monitoring as a guide for microvascular decompression. Neurosurgery 2001;49:1365-1370; discussion 1370.


31. Shin JC, Chung UH, Kim YC, Park CI: Prospective study of microvascular decompression in hemifacial spasm. Neurosurgery 1997;40:730-734; discussion 734.


32. Joo WI, Lee KJ, Park HK, Chough CK, Rha HK: Prognostic value of intra-operative lateral spread response monitoring during microvascular decompression in patients with hemifacial spasm. J Clin Neurosci 2008;15:1335-1339.


33. Thirumala PD, Wang X, Shah A, et al: Clinical impact of residual lateral spread response after adequate microvascular decompression for hemifacial spasm: A retrospective analysis. Br J Neurosurg 2015;29:818-822.


34. Yang M, Zheng X, Ying T, et al: Combined intraoperative monitoring of abnormal muscle response and Z-L response for hemifacial spasm with tandem compression type. Acta Neurochir (Wien) 2014;156:1161-1166; discussion 1166.


35. Zheng X, Hong W, Tang Y, et al: Discovery of a new waveform for intraoperative monitoring of hemifacial spasms. Acta Neurochir (Wien) 2012;154:799-805.


36. Son BC, Ko HC, Choi JG: Intraoperative monitoring of Z-L response (ZLR) and abnormal muscle response (AMR) during microvascular decompression for hemifacial spasm. Interpreting the role of ZLR. Acta Neurochir (Wien) 2018;160:963-970.

37. Kimura J: Current understanding of F-wave physiology in the clinical domain. Suppl Clin Neurophysiol 2006;59:299-303.


38. Ishikawa M, Ohira T, Namiki J, et al: Electrophysiological investigation of hemifacial spasm after microvascular decompression: F waves of the facial muscles, blink reflexes, and abnormal muscle responses. J Neurosurg 1997;86:654-661.









